Քիմիական տարի նշան
Ag
Կարգաթիվ
47
Միջուկի լիցք
+47
Հարաբերական ատոմային զանգված Ar
Ar(Y)=108
Մեկ ատոմի զանգված Mo
Mo(Y)=1765,8
Ատոմի բաղադրություն
(47p. 61n) 47e
Պարբերություն
5
Խումբ և ենթախումբ
1 խումբ 2 ենթախումբ
Ատոմի կառուցվածք
1S(1), 2S(2) 2P(6) 2D(10), 3S(2) 3P(6) 3D(10), 4S(2) 4P(6), 5P(2)
Մետաղ է
Բնության մեջ
Բնության մեջ արծաթը հանդիպում է ինչպես բնածին վիճակում, այնպես էլ
միացությունների ձևով (արգենտիտ, պիրարգիրիտ, կերարգիրիտ): Արծաթի հիմնական մասը, որպես կողմնակի արգասիք, կորզվում է այլ մետաղների (ցինկ, կապար, կոբալտ, պղինձ) արդյունահանման ժամանակ:
 |
Արծաթե կանթեղ (1734 թ.)
|
Ստացում
Արդյունաբերության մեջ արծաթը ստանում են հիմնականում կապարի և պղնձի կոնցենտրատների վերամշակումից։ Սև պղնձից արծաթը անջատում են էլեկարոլիտային ռաֆինացման ժամանակ։ Սև կապարից արծաթն անջատում են ցինկի միջոցով։ Լուծվելով ցինկում՝ այն անջատվում է ցինկի փրփուրի հետ, որից ցինկը հեռացնում են թորելով (1250 °C)։
Արծաթի վերջնական մաքրումը կատարվում է էլեկտրոլիզով։ Արծաթային հանքանյութերից արծաթը ստանալու համար հանքանյութերը ենթարկում են գրավիտացիոն հարստացման, ապա անջատում են արծաթը ցիանացման եղանակով։ Պիրիտային և այլ թափոննելում պարունակվող արծաթը անջատելու համար ենթարկում են քլորացնող բովման և ապա ցիանացման։ Ցիանային լուծույթից արծաթը նստեցնում են ցինկով կամ ալյումինով։ Արծաթը անջատում են նաև իոնափոխանակման եղանակով և օրգանական լուծիչներով էքստրակտելով։
Քիմիական հատկություններ
Խոնավ օդում արծաթը կլանում է թթվածին՝ առաջացնելով օքսիդի չափազանց բարակ (~12A) պաշտպանական շերտ։
Արծաթի միացությունները թթվածնի հետ ստանում են անուղղակի ճանապարհով։ Հայտնի են Ag2O և AgO կայուն և չափազանց անկայուն Ag2O3 օքսիդները։
Ag2O լույսի ազդեցությամբ դանդաղ քայքայվող դարչնագույն բյուրեղական նյութ է։
Հեշտությամբ վերականգնվում է ջրածնով։ Լուծվում է ջրում (0,013 գ/լ, 20 °C-ում), թթուներում և ամոնիումի հիդրօքսիդում։
Օգտագործվում է օրգանական սինթեզում, հակագազերում։ Ag2O-ի ջրային լուծույթը հիմնային է, որը, ըստ երևույթին, արծաթի հիդրօքսիդի (AgOH) առկայության արդյունք է։ AgO մուգ մոխրագույն մետաղափայլ բյուրեղական նյութ է։ Քայքայվում է 100 °C-ում, 110 °C-nւմ պայթյունով։ Լուծվում է թթուներում, օքսիդիչ է։ Օգտագործվում է «գերօքսիդային» գալվանական էլեմենտներ պատրաստելիս։ Ատոմական ջրածնի և արծաթի փոխազդմամբ ստացվում է արծաթի հիդրիդը՝ AgH, որը խոնավության առկայությամբ արագ քայքայվող սպիտակ բյուրեղական նյութ է։
Սենյակային ջերմաստիճանում արծաթը փոխազդում է հալոգենների հետ՝ առաջացնելով համապատասխան հալոգենիդի պաշտպանական շերտ։ Ջերմաստիճանի բարձրացումը և խոնավության առկայությունը հեշտացնում են հալոգենիդի առաջացումը։ AgF բաց դեղնավուն, ամորֆ նյութ է։ Լավ լուծվում է ջրում։ AgF2 և Ag2F ջրի առկայությամբ անկայուն են։
Չոր օդում և տեսանելի լույսի ազդեցությամբ ֆտորիդները կայուն են։
Արծաթի յոդիդը (բաց դեղնավուն բյուրեղներ) ջրում վատ լուծվող նյութ է։ Լույսի ազդեցությամբ քայքայվում է, օգտագործվում է լուսանկարչության մեջ։ Արծաթը միանում է ծծմբին և նրա ցնդող միացություններին՝ առաջացնելով սուլֆիդ՝ Ag2S , որը սև, ջրում անլուծելի լուսազգայուն նյութ է․ ստացվում է արծաթի լուծելի աղերիև ծծմբածխածնի փոխազդմամբ։
Արծաթը ազոտին անմիջականորեն չի միանում։ Հայտնի են անկայուն արծաթի նիտրիդը՝ Ag3N (շագանակագույն, պինդ նյութ), և արծաթի ազիդը՝ AgN3 (սպիտակ բյուրեղներ, որոնք տաքացնելիս կամ հարվածից պայթում են։
Ածխածինը միանում է արծաթին միայն շիկացնելիս՝ առաջացնելով արծաթի կարբիդ՝ Ag2C2, որը սպիտակ փոշի է, պայթում է հարվածից և ուժեղ լուսավորումից։
Մետաղների հետ արծաթը առաջացնում է համաձուլվածքներ։ Ա․ լուծվում է թթուներում միայն օքսիդիչների առկայությամբ։
Լավ լուծվում է HNO3-ում, եռացող խիտ է H2SO4-ում։ Արծաթի աղերը մեծմասամբ ջրում վատ են լուծվում։
Լավ լուծվում են նիտրատը, ֆտորիդը, գերքլորատը։ Լուծելի աղերը անգույն են և թունավոր։ Արծաթի սուլֆատը՝ Ag2SO4, սպիտակ բյուրեղական, ջրում վատ լուծվող նյութ է (0,79 գ, 100 մլ ջրում, 20 °C)։
Արծաթի կարբոնատը՝ Ag2CO3, դեղնավուն, լուսազգայուն նյութ է, օգտագործվում է օրգանական սինթեզում։ Արծաթի աղերը համապատասխան անիոնների ավելցուկի առկայությամբ առաջացնում են կոմպլեքսային միացություններ՝ K[Ag(CN)2], K3[AgCl4] և այլն։ Արծաթի իոնների ամենաչնչին քանակներն անգամ (2,15•10−9 գ/լ) ունեն մանրէասպան հատկություն։
![\mathsf{ 2Na[Ag(CN)_{2}] + Zn = Na_{2}[Zn(CN)_{4}] + 2Ag}](https://upload.wikimedia.org/math/d/4/2/d426625a2721c8c6f6ae0192c7daef6d.png)
- Ֆիզիկական հատկություններ
- Արծաթը գեղեցիկ, սպիտակափայլ մետաղ է։ Հալման ջերմաստիճանը՝ 960,5 °C, եռմանը՝ 2212 °C, խտությունը՝ 10503,4 կգ/մ3։ Արծաթը ավելի լավ է հայտնի քան մյուս մետաղները, անդրադարձնում է լույսը (հատկապես ինֆրակարմիր), հաղորդում է ջերմությունը և էլեկտրականությունը։ Չափազանց պլաստիկ է, արծաթից կարելի է գլանել մինչև 10-8 մմ հաստության փայլաթիթեղ։ Քիմիապես քիչ ակտիվ, միացություններում միարժեք, երբեմն երկարժեք և եռարժեք է։Արծաթը կտրվում է դանակով, 1 գրամը ձգվում է շուրջ 1800 մետր և գլանվում մինչև 0,00025 մմ հաստությամբ նրբաթիթեղի, փայլեցվում է մինչև հայելափայլի, անդրադարձման գործակիցը 95-97% է, կայուն է հիմքերի, օքսիդների, կոռոզիայի նկատմամբ, բայց լուծվում է խիտ ազոտական թթվում, կալիումի ցիանիդի լուծույթում, անգամ օդի աննշան ծծմբային գազից սևանում է՝ ծածկվելով արծաթի սուլֆատի ¥AgS¤շերտով։ Արծաթի օրինականացված հարգերն են՝ 800,830,875,925,960։ Որքան ցածր է արծաթի հարգը, այնքան շուտ է այն սևանում։ Տարեկան հանույթը կազմում է 100000 տ, հիմնական արտահանողներն ենՄեքսիկան, Կանադան, ԱՄՆ-ն։
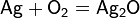
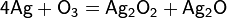
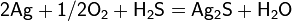


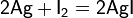
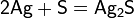



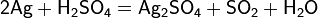

No comments:
Post a Comment